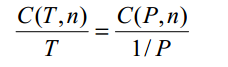La deducción de las leyes de
los gases ideales a partir de la teoría
Para empezar este tema
debemos definir la palabra deducción la
cual es una forma de razonamiento que consiste en partir de un principio general conocido para llegar a un principio particular desconocido.
Con esta definición se puede aclarar lo
principal del tema así que a continuación Vamos a deducir la ley de los gases
ideales (PV = nRT) a partir de las leyes experimentales clásicas de los gases:
Avogadro, Boyle y Charles y Gay-Lussac.
LEYES
EXPERIMENTALES DE LOS GASES
Ley de Avogadro: A
presión y temperatura constantes, el volumen que ocupa un gas es directamente
proporcional al número de partículas1
(y, por lo tanto, también de moles)2 que contiene dicho gas. Puesto que
dos magnitudes son directamente proporcionales cuando su cociente es constante,
la ley se expresa matemáticamente como
V / n = C (T, P)
Donde
n representa el número de moles, V el volumen que ocupa y C (T, P) una
constante que depende de T y P (pues su valor cambia si se modifican T o P)
Ley
de Boyle: Para una cantidad fija de un gas a temperatura
constante, el volumen que ocupa es inversamente proporcional a la presión que
ejerce. Ya que dos magnitudes son inversamente proporcionales cuando su
producto es constante, la ley se expresa matemáticamente como,
PV
= C (T, n)
Donde P representa la
presión, V el volumen que ocupa y C (T, n) una constante que depende de T y n
(ya que su valor varía si cambiamos n o T).
Ley
de Charles y Gay-Lussac: Para una cantidad fija de un gas a
presión constante, el volumen que ocupa es directamente proporcional a la
temperatura a la que se encuentra, es decir,
V
/T = C (P, n)
Donde T representa la
temperatura, V el volumen que ocupa y C (P, n) una constante que depende de P y
n (puesto que su valor cambia si modificamos n (P).
A continuación haremos la
deducción de las leyes experimentales de los gases.
Al despejar el volumen de
las tres ecuaciones anteriores, tenemos que
La ecuación (1) se puede
escribir como,
Donde el primer miembro no
depende de P y el segundo no depende de T. Por lo tanto, como son iguales,
ambos tienen que ser independientes de P y de T; es decir, se trata de una
constante si n no cambia. Así que se cumple que
Donde C(n) es una constante
que sólo depende de n. Despejando C (T, n)
,
Y llevando este resultado a la ley de Boyle queda que,
La
ecuación (2) se puede escribir como,
Donde el primer miembro no
depende de n y el segundo no depende de T. Por lo tanto, como son iguales,
ambos tienen que ser independientes de n y de T; es decir, se trata de una
constante si P no cambia. Así que se cumple que,
Donde C (P) es una constante
que sólo depende de P. Despejando), C (P, n),
Y llevando este resultado a
la ley de Charles y Gay-Lussac queda que,
Combinando las ecuaciones
(3) y (4),
Donde el primer miembro no
depende ni de T ni de P y el segundo no depende ni de T ni de n. Por lo tanto,
como son iguales, ambos tienen que ser independientes de T de P y de n; es
decir, se trata de una constante absoluta, R. Así que se cumple que,
E insertando este resultado
en la ecuación (3) se tiene que,
Que es la ecuación de estado
de los gases ideales.
La ecuación (5) se puede
escribir también,
Sea una cantidad fija de gas
a temperatura T1, volumen V1 y presión P1. Si modificamos las variables de
estado a otros valores diferentes T2, V2 y P2 (sin modificar la cantidad de
gas), entonces, de la ecuación (6) se desprende que,
Que es otra forma de
expresar la ley para una cantidad de gas constante.
Después de haber llegado a
esta deducción podemos definir lo que es un gas ideal, se define como gas
ideal, aquel donde todas las colisiones entre átomos o moléculas son
perfectamente elásticas, y en el que no hay fuerzas atractivas
intermoleculares. Se puede visualizar como una colección de esferas
perfectamente rígidas que chocan unas con otras pero sin interacción entre
ellas. En tales gases toda la energía
interna está en forma de energía cinética y cualquier
cambio en la energía interna va acompañada de un cambio en la temperatura. Un
gas ideal se caracteriza por tres variables
de estado: la presión absoluta (P), el volumen (V), y la
temperatura absoluta (T). La relación entre ellas se puede deducir de la teoría
cinética y constituye la ley de los gases ideales
LEY
DE LOS GASES IDEALES: PV=Nrt= NkT
n = número de moles
R = constante universal de
gas = 8.3145 J/mol K
N = número de moléculas
k = constante de Boltzmann =
1.38066 x 10-23 J/K = 8.617385 x 10-5eV/K
k = R/NA
NA = número de Avogadro
= 6.0221 x 1023 /mol
La ley del gas ideal puede
ser vista como el resultado de la cinética de las moléculas del gas
colisionando con las paredes del contenedor de acuerdo con las leyes de Newton.
Pero también hay un elemento estadístico en la determinación de la energía
cinética media de esas moléculas. La temperatura se considera proporcional a la
energía cinética media; lo cual invoca la idea de temperatura
cinética. Una mol de gas ideal a TPE (temperatura
y presión estándares), ocupa 22,4 litros.
Bibliografía: